Estructura de la matèria
Mecànica quàntica, orbitals atòmics, estructura electrònica i partícules subatòmiques
 Imatge de LoveYouAll en Pixabay
Imatge de LoveYouAll en Pixabay
Índex
Models atòmics
Dalton
Basant-se en les idees de Demòcrit, John Dalton proposà aquest model a principis del segle XIX, considerant l’àtom com a una esfera massissa indivisible.

Els descobriments de la radioactivitat natural per Becquerel (1896) i l’electró per Thomson (1897) van fer necessària la revisió d’aquest model.
Thomson
També conegut com el model del pastís de panses, va ser proposat el 1904 per J.J. Thomson, el qual considera que l’àtom està format per un núvol esfèric amb càrrega positiva on es troben incrustats els electrons, amb càrrega negativa, com les panses en un pastís.

Els descobriments del nucli atòmic i del protó per Rutherford (1911 i 1919, respectivament) van portar a la revisió d’aquest model.
Rutherford
Gràcies al seu famós experiment de la làmina d’or (Au), Ernest Rutherford va proposar, el 1911, un model d’àtom format per un nucli, molt petit comparat amb el tamany de l’àtom, amb càrrega positiva i on es concentra quasi tota la seva massa. Els electrons, amb càrrega negativa, giren al voltant del nucli com ho fan els planetes al voltant del Sol.

La integritat del nucli1 i la inestabilitat de les òrbites electròniques2 des d’un punt de vista clàssic van fer necessària la revisió d’aquest model.
Bohr
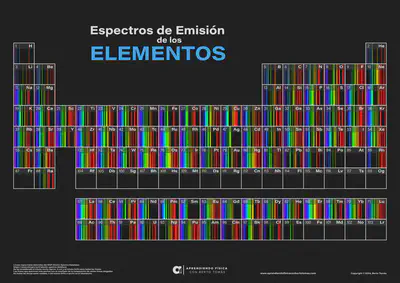
Proposat el 1913 per Niels Bohr per explicar l’estabilitat de la matèria i els característics espectres d’emissió i absorció dels gasos.


Vols veure com són els espectres d’emissió de la resta d’elements químics de la taula periòdica? Clica aquí
Postulats
Aquest model es basa en tres postulats fonamentals:
- Els electrons descriuen òrbites circulars al voltant del nucli sense irradiar energia.
- Només estan permeses aquelles òrbites en les quals l’electró té un moment angular múltiple enter de $\hbar = h/(2\pi)$.
- L’electró només emet o absorveix energia en els salts d’una òrbita permesa a una altra, sent l’energia emesa/absorvida la diferència d’energia entre ambdós nivells.

Equació de Rydberg
L’equació de Rydberg ens dona la longitud d’ona de les línies espectrals de molts elements químics. Pel cas de l’hidrogen:
$$ \frac{1}{\lambda} = R_\mathrm H\cdot\left(\frac{1}{n_1^2}-\frac{1}{n_2^2}\right), $$on $\lambda$ és la longitud d’ona de la radiació emesa en el buit, $R_\mathrm H = 1.097\times 10^7\thinspace \mathrm m^{-1}$ és la constant de Rydberg i $n_1$ i $n_2$ són els nombres quàntics principals de les òrbites involucrades en el salt (amb $n_2>n_1$).
Aquesta equació també ens permet calcular el valor energètic corresponent a una transició electrònica entre dos nivells donats, $\Delta E$:
$$ \Delta E = hcR_\mathrm H\cdot\left(\frac{1}{n_1^2}-\frac{1}{n_2^2}\right), $$on $h = 6.626\times 10^{-34}\thinspace\mathrm{J\thinspace s}$ és la constant de Planck i $c = 299\thinspace 792\thinspace 458\thinspace \mathrm{m/s}$ és la velocitat de la llum en el buit.
T’agraden les matemàtiques i vols saber més sobre el model de Bohr, arribant a deduir l’equació de Rydberg? Clica aquí
L’equació de Rydberg ens permet calcular el valor energètic corresponent a una transició electrònica entre dos nivells donats, $\Delta E$. Escriurem primer l’expressió que ens dona l’energia total d’un electró movent-se en una òrbita (suposadament circular):
$$ E = E_\mathrm c + E_\mathrm p, $$on $E_\mathrm c$ és l’energia cinètica i $E_\mathrm p$ l’energia potencial elèctrica de l’electró: \begin{align*} E_\mathrm c &= \frac{1}{2}mv2 \\ E_\mathrm p &= -\frac{ke2}{r} \end{align*}
L’única força a la que està sotmesa l’electró és la força d’atracció elèctrica per part del nucli. Aquesta força, per tant, actuarà com una força centrípeta:
\begin{align} \lvert F_\mathrm e\rvert &= \lvert f_\mathrm c\rvert \\ \frac{ke2}{r2} &= \frac{mv2}{r} \rightarrow mv2 = \frac{ke^2}{r} \end{align}
I per tant podem escriure l’energia total com:
$$ E = \frac{1}{2}\frac{ke^2}{r}-\frac{ke^2}{r} = -\frac{1}{2}\frac{ke^2}{r} $$El segon postulat del model de Bohr imposa una condició per les òrbites permeses, cosa que significa que el radi de l’òrbita, $r$, està quantitzat: \begin{align*} mvr &= n\hbar \\ v &= \frac{n\hbar}{mr} \rightarrow v2 = \frac{n2\hbar2}{m2r^2} \end{align*}
Substituint en l’anterior relació obtinguda a partir de la força centrípeta:
\begin{align*} mv2 &= \frac{ke2}{r} \\ \frac{n2\hbar2}{mr2} &= \frac{ke2}{r} \rightarrow r = \frac{n2\hbar2}{ke^2m} \end{align*}
Pel que podem escriure l’energia total com:
$$ E = -\frac{1}{2}\frac{ke^2}{r} = -\frac{k^2e^4m}{2n^2\hbar^2} = -\frac{\mathrm{cte}}{n^2}, $$on $\mathrm{cte} = k^2e^4m/(2\hbar^2)$ pot escriure’s com $\mathrm{cte} = hcR_\mathrm H$, sent $R_\mathrm H$ la constant de Rydberg. La variació d’energia entre dos nivells donats és per tant:
$$ \Delta E = hcR_\mathrm H\cdot\left(\frac{1}{n_1^2}-\frac{1}{n_2^2}\right) $$Orígens de la teoria quàntica
Radiació de cos negre
És la radiació electromagnètica reemesa per un cos ideal que absorveix tota la radiació que incideix sobre ell (cos negre), estant en equilibri termodinàmic amb el seu entorn.

Té un espectre molt característic, inversament relacionat amb la intensitat, que depèn únicament de la temperatura del cos.
).](/media/estructura-materia-2Bach-quimica/radiacion-cuerpo-negro-cat.svg)
La incapacitat de la teoria clàssica vigent a l’hora d’explicar la forma d’aquest espectre es coneix com a catàstrofe ultraviolada.
Max Planck fou qui conseguí, el 1900, explicar l’espectre del cos negre, donant així origen a la teoria quàntica.
Aprèn més sobre la radiació de cos negre amb aquesta excel·lent simulació:
Hipòtesi de Planck
L’energia només pot ser emesa/absorvida en paquets discrets anomenats quants o fotons, múltiples de la freqüència $\nu$ de la radiació electromagnètica associada:
$$ E = h \nu, $$on $h = 6.626\times 10^{-34}\thinspace\mathrm{J\thinspace s}$ és la constant de Planck.
Efecte fotoelèctric
L’efecte fotoelèctric consisteix en l’emissió de (foto)electrons quan radiació electromagnètica, com per exemple llum ultraviolada, incideix sobre un material, típicamente metàl·lic.
Característiques
- La quantitat de fotoelectrons emessos és directament proporcional a la intensitat de la radiació incident.
- L’emissió de fotoelectrons només es produeix quan la radiació incident té una freqüència major o igual que una certa freqüència mínima, anomenada freqüència umbral o de tall, $\nu_0$, que és característica de cada material.
- L’energia cinètica dels fotoelectrons depèn únicament de la freqüència de la radiació incident.
- L’emissió de fotoelectrons es realitza instantàniament, sense existir cap retràs entre l’absorció d’energia i l’emissió dels fotoelectrons.

\begin{align*} E &= \phi + E_\mathrm c \\ h\nu &= h\nu_0 + E_\mathrm c \Rightarrow E_\mathrm c = h\left(\nu-\nu_0\right), \end{align*}
on $h = 6.626\times 10^{-34}\thinspace\mathrm{J\thinspace s}$ és la constant de Planck, $\nu$ és la freqüència de la radiació incident, $\nu_0$ és la freqüència umbral (l’energia associada de la qual, $\phi = h \nu_0$ es denomina funció de treball o treball d’extracció) i $E_\mathrm c = h\left(\nu-\nu_0\right)$ és l’energia cinètica màxima dels fotoelectrons, emessos sempre que es compleixi $\nu \geq \nu_0$.
Mecànica quàntica
Dualitat ona-corpuscle
Consisteix en què el comportament dels objectes quàntics no pot ser descrit considerant a aquests com a partícules o ones, sinó que tenen una naturalesa dual.

A partir d’experiments de difracció d’electrons, Louis de Broglie va ser el primer que va proposar la següent hipòtesi:
Tota partícula de massa $m$ movient-se a una velocitat $v$ té associada una ona (de matèria) la longitud d’ona de la qual, $\lambda$, ve donada per
$$ \lambda = \frac{h}{mv}, $$sent $h = 6.626\times 10^{-34}\thinspace\mathrm{J\thinspace s}$ la constant de Planck.
En el següent vídeo de Quantum Made Simple (en anglès) pots aprende més sobre la dualitat ona-corpuscle:
Principi d’incertesa de Heisenberg
Existeixen certs parells de magnituds físiques (aquelles el producto del qual tenen dimensions de $\mathsf{M}\mathsf{L}^2\mathsf{T}^{-1}$), que no poden ser determinades simultàniament amb total exactitud, ja que el producte de les seves incerteses ha de ser major o igual que $h/(4\pi) = \hbar/2$.
Exemples de tals magnituds són:
\begin{align*} \text{Posició $x$ i moment lineal $p$: } & \Delta x \cdot \Delta p \geq \frac{\hbar}{2} \\ \text{Energia $E$ i temps $t$: } & \Delta E \cdot \Delta t \geq \frac{\hbar}{2} \end{align*}
on $\Delta$ denota la incertesa associada i $\hbar = h/(2\pi)$.
El principi d’incertesa de Heisenberg implica que, encara que s’especifiquin totes les condicions inicials, no és possible predir el valor d’una quantitat amb total certesa, donant així pas a una interpretació probabilística de la mecànica quàntica.
Orbitals atòmics
Són funcions matemàtiques3 que descriuen la mida, la forma i l’orientació de les regions de l’espai on és possible trobar l’electró4.

Nombres quàntics i la seva interpretació
Els nombres quàntics descriuen valors de magnituds físiques que es conserven en la dinàmica d’un sistema quàntic, tals como l’energia o el moment angular, les quals estan quantitzades i per tant prenen valors discrets.
Per descriure completament l’estat quàntic d’un electró en un àtom necessitem quatre nombres quàntics, els quals tenen un significat orbital concret.
Nombre quàntic principal $n$
Ens dona el mida i l’energia de l’orbital. Pren valors naturals ($1\leq n$), com per exemple $n = 1,2,3,\dots$
Nombre quàntic secundari $l$
Ens dona l’energia i forma de l’orbital. Pot prendre els següents valors:
$$ 0\leq l\leq n-1 $$de manera que, per exemple, per $n = 3$: $l=\\{0,1,2\\}$.
Nombre quàntic magnètic $m_l$
Ens dona l’orientació de l’orbital. Pot prendre els següents valors:
$$ -l\leq m_l\leq l $$de manera que, per exemple, per a $l = 2$: $m_l=\\{-2,-1,0,1,2\\}$.
Espín $m_s$
És el moment angular intrínsec. Pot prendre els següents valors:
$$ -s\leq m_s\leq s $$Per a un electró, $s=1/2$, pel que $m_s = \\{-1/2,1/2\\}$.
Coneix més sobre l’espín en aquest magnífic vídeo de Quantum Made Simple (en anglès):
Estructura electrònica
Principi d’exclusió de Pauli
Dos o més electrons no poden tenir tots els seus nombres quàntics idèntics (ocupar el mateix estat quàntic) dintre del mateix sistema quàntic (àtom).
Gràcies a aquest principi podem determinar el nombre màxim d’electrons que caben en cada tipus d’orbital:
| Tipus d’orbital | s | p | d | f |
|---|---|---|---|---|
| Nombre d’orbitals | 1 | 3 | 5 | 7 |
| Nombre màxim d’e– | 2 | 6 | 10 | 14 |
Ordre energètic creixent
La configuració electrònica és la distribució dels electrons d’un àtom en orbitals atòmics (s, p, d i f).

El diagrama de Möller ens ajuda a saber en quin ordre han d’omplir-se els diferents orbitals, seguint les fletxes (ordre energètic creixent).

Regla de Hund de la màxima multiplicitat
En omplir orbitals d’igual energia (per exemple els tres orbitals p) els electrons es distribueixen, sempre que sigui possible, amb els seus espins paral·lels, omplint els orbitals amb una multiplicitat major.
Exemples
Es mostren també els nombres quàntics de l’últim electró:

Partícules subatòmiques
Després dels descobriments de Thomson, Rutherford i Chadwick a principis del segle XX, semblava clar que l’àtomo estava format per protons i neutrons en el seu nucli i una escorça on estaven els electrons.
| Partícula | Massa/kg | Càrrega/C |
|---|---|---|
| Protó | $1.673\times 10^{-27}$ | $1.602\times 10^{-19}$ |
| Neutró | $1.675\times 10^{-27}$ | $0$ |
| Electró | $9.109\times 10^{-31}$ | $-1.602\times 10^{-19}$ |
Model estàndard
És la teoria que descriu tres de les quatre interaccions fonamentals de la naturalesa conegudes (electromagnètica, nuclear forta i nuclear dèbil), a més a més de classificar totes les partícules elementals conegudes.

Evolució de l’Univers
 de https://www.flaticon.es/.](/media/estructura-materia-2Bach-quimica/evolucion-universo-cat.svg)
-
Si el nucli estigués format únicament per protons amb càrrega positiva, la seva repulsió faria que es desintegrés. El 1932 Chadwick descobreix el neutró, partícula sense càrrega encarregada de mantenir units entre si els protones mitjançant la força nuclear forta. ↩︎
-
La física clàssica prediu que una partícula carregada i accelerada, com seria el cas dels electrons orbitant al voltant del nucli, emet radiació electromagnètica, perdent energia i col·lapsant contra el nucli. ↩︎
-
Solucions complexes de l’equació de Schrödinger per a un electró lligat a un àtom. ↩︎
-
El quadrat de l’amplitud d’aquestes funcions està relacionat amb la probabilitat de trobar un electró qualsevol d’un àtom en una regió específica al voltant del nucli d’aquest àtom. Això és el que es coneix com a norma de Born, dins de la interpretació de Copenhaguen. ↩︎
Participa activament a la web comentant, donant la teva opinió, realitzant peticions, suggeriments...
Discord