 Imatge de LoveYouAll a Pixabay
Imatge de LoveYouAll a Pixabay
Índex
Descobriment de l’electró
Al 1897, J.J. Thomson duu a terme el seu famós experiment del tub de raigs catòdics, amb el qual descobreix l’electró, la partícula elemental amb càrrega elèctrica negativa.

Resultats de l’experiment
Els resultats de l’experiment van ser:
- Els raigs catòdics s’originaven al càtode i viatjaven cap a l’ànode.
- Els raigs no eren visibles però podien detectar-se amb una pantalla fluorescent.
- En absència de camps electromagnètics externs, els raigs viatjaven en línia recta.
- En aplicar camps elèctrics i magnètics, els raigs catòdics mostraven un comportament similar al de partícules amb càrrega negativa.
- Les característiques dels raigs catòdics eren independents de la naturalesa del gas contingut dins del tub i del material del qual estaven formats els elèctrodes.
Model de Thomson
Set anys després del seu famós experiment, al 1904, Thomson postula un model atòmic que es coneix com el model del pastís de panses:
- L’àtom està format per un núvol esfèric amb càrrega positiva.
- Els electrons, amb càrrega negativa, es troben incrustats per tota l’esfera, com les panses en un pastís.
- El nombre total d’electrons és tal que la càrrega neta de l’àtom és zero (àtom neutre).

Descobriment del nucli atòmic
Al 1911, Geiger i Marsden, dirigits per Ernest Rutherford, duen a terme un experiment històric en el qual descobreixen l’existència del nucli atòmic:

Resultats de l’experiment
- La majoria de les partícules travessaven la làmina d’or sense desviar-se.
- Molt poques (1/10000 aproximadament) es desviaven un angle major d’uns 10°.
- Algunes partícules (poquíssimes) fins i tot rebotaven.
Interpretació de Rutherford

- Si el model proposat per Thomson fos cert, no haurien d’observar-se desviacions ni rebots de les partícules incidents.
- Les partícules es desvien en trobar a la seva trajectòria una zona molt petita (nucli) carregada positivament, on es concentra la major part de la massa de l’àtom.
Pots entendre millor les conclusions del experiment de Rutherford amb aquesta simulació:
Model de Rutherford
- L’àtom està format per un nucli, molt petit comparat amb la grandària de l’àtom, amb càrrega positiva i on es concentra gairebé tota la seva massa.
- Els electrons, amb càrrega negativa, giren al voltant del nucli com fan els planetes al voltant del Sol.

Model de Bohr
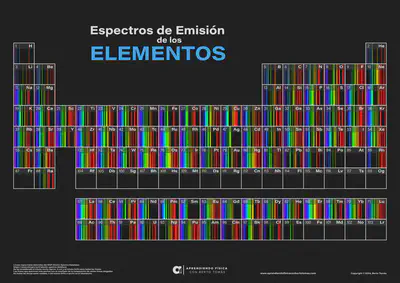
Proposat al 1913 per Niels Bohr per a explicar l’estabilitat de la matèria i els característics espectres d’emissió i absorció dels gasos.


Vols veure com són els espectres d’emissió de la resta d’elements químics de la taula periòdica? Punxa aquí
Postulats
Aquest model es basa en tres postulats fonamentals:
- Els electrons descriuen òrbites circulars entorn del nucli sense irradiar energia.
- Només algunes òrbites estan permeses.
- L’electró només emet o absorbeix energia en els salts d’una òrbita permesa a una altra, sent l’energia emesa/absorbida la diferència d’energia entre tots dos nivells.

Participa activament a la web comentant, donant la teva opinió, realitzant peticions, suggeriments...
Discord