Enllaç químic
- Regla de l’octet
- Paràmetres moleculars
- Enllaç iònic
- Enllaç metàl·lic
- Enllaç covalent
- Geometria molecular
- Forces intermoleculars
Descarrega aquestes diapositives en format PDF 📥
Regla de l’octet
La configuració més estable per a qualsevol àtom és comptar amb vuit electrons a la capa exterior.
(continua cap avall)
👇
Els elements tendiran a unir-se per a completar la seva capa exterior, intercanviant (cedint/captant $\rightarrow$ enllaç iònic) o compartint electrons (enllaç covalent), i així guanyar estabilitat.
Paràmetres moleculars
Energia d’enllaç
És una mesura de la fortalesa d’un enllaç químic.

Longitud d’enllaç
Distància mitjana entre els nuclis de dos àtoms enllaçats.
Angle d’enllaç
Angle format per tres àtoms enllaçats consecutivament.
Polaritat d’enllaç
És la separació de càrregues elèctriques al llarg d’un enllaç, donant lloc a un moment dipolar elèctric. La diferència d’electronegativitat, $\Delta \chi$, entre els àtoms d’un enllaç determina la seva polaritat:

Una molècula serà polar si el moment dipolar total (suma vectorial) és diferent de zero.
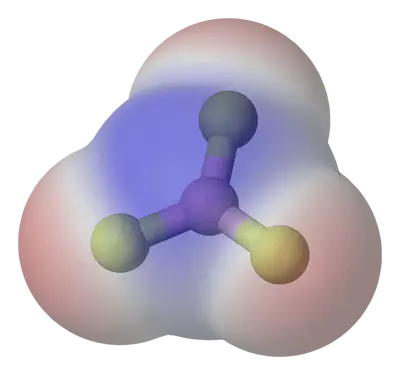
Estudia la polaritat de molècules amb aquesta simulació:
Enllaç iònic
És un enllaç que involucra l’atracció electroestàtica entre ions de signe oposat.
(continua cap avall)
👇
L’enllaç iònic sol donar-se entre metalls (tendeixen a cedir electrons, convertint-se en cations) i no metalls (tendeixen a captar electrons, convertint-se en anions).
Els compostos iònics formen xarxes cristal·lines compactes i neutres amb diferents geometries segons els ions que les formen.


Energia de xarxa $U_\mathrm R$
És l’energia alliberada al formar-se la xarxa a partir del seus ions en estat gasós.
Cicle de Born-Haber

Equació de Born-Landé
Permet calcular l’energia de xarxa $U_\mathrm R$:
$$ U_\mathrm R = -\frac{N_\mathrm A M z^+ z^- e^2}{4\pi\epsilon_0 r_0}\left(1-\frac{1}{n}\right), $$on $N_\mathrm A = 6.022\times 10^{23}\thinspace\mathrm{mol^{-1}}$ és la constant d’Avogadro; $M$ és la constant de Madelung, relacionada amb la geometria del cristall; $z^+$ i $z^-$ són els números de càrrega del catió i de l’anió, respectivament;
$e = 1.6\times 10^{-19}\thinspace\mathrm{C}$ és la càrrega elemental, $\epsilon_0 = 8.85\times 10^{-12}\thinspace\mathrm{C^2N^{-1}m^{-2}}$ és la permitivitat elèctrica al buit; $r_0$ és la distància a l’ió més pròxim; i $5
Es comprova que el mòdul de l’energia de xarxa és:
- Directament proporcional al producte de les càrregues dels ions.
- Inversament proporcional a la distància interiònica.
Propietats de les substàncies iòniques
- A causa de les intenses forces electroestàtiques entre els ions, solen tenir temperatures de fusió i ebullició molt elevades, per la qual cosa la majoria són sòlids cristal·lins a temperatura ambient.

🔵 $\rightarrow$ sodi (Na); 🟢 $\rightarrow$ clor (Cl).
- Davant cops, l’alineament dels ions positius i negatius pot perdre’s, per la qual cosa són molt fràgils, encara que també molt durs.
- Fosos o en dissolució, condueixen el corrent elèctric.
Enllaç metàl·lic
L’enllaç metàl·lic és l’enllaç químic que manté units als àtoms d’un metall entre si.
(continua cap avall)
👇
Sorgeix de l’atracció electroestàtica entre els electrons de conducció i els cations metàl·lics.
Model del gas electrònic

Teoria de bandes

Pots aprendre més sobre la teoria de bandes i com aquesta explica la conductivitat elèctrica en aquest excel·lent article.
També et recomano donar un cop d’ull a aquest magnífic vídeo de Quantum Made Simple (en anglès):
Propietats de les substàncies metàl·liques
- Aparença brillant.
- Són bons conductors de la calor i de l’electricitat.
- Formen aliatges amb altres metalls.
- Tendeixen a cedir (perdre) electrons en reaccionar amb altres substàncies.
- La majoria són sòlids a temperatura ambient (Hg és 💧).
Enllaç covalent
És un enllaç químic que implica la compartició de parells d’electrons entre àtoms.
(continua cap avall)
👇
L’enllaç covalent sol donar-se entre no metalls (tendència a captar electrons).

Estructures de Lewis
Es tracta de diagrames que mostren la unió entre els àtoms d’una molècula i els parells solitaris d’electrons que poden existir a la molècula.
Les estructures de Lewis mostren cada àtom i la seva posició en l’estructura de la molècula usant el seu símbol químic.
Es dibuixen línies entre els àtoms que estan units entre si (es poden utilitzar parells de punts en lloc de línies).
L’excés d’electrons que formen parells solitaris es representen com a parells de punts, i es col·loquen al costat dels àtoms.
Exemples
Aigua (H2O)

Oxigen (O2)

Diòxid de carboni (CO2)

Enllaç covalent coordinat o datiu
Es tracta d’enllaços en els quals un sol element (donador) aporta el parell d’electrons, el qual és acceptat per un altre element que té un orbital buit (acceptor).
És un enllaç molt comú i clau per a entendre el concepte àcid-base de Lewis, en el qual l’àcid és l’espècie que accepta el parell d’electrons (acceptor) i la base l’espècie que ho cedeix (donador).

Ressonància
La ressonància és una manera de descriure l’enllaç en unes certes molècules mitjançant la combinació de diverses estructures ressonants el conjunt de les quals es coneix com un híbrid de ressonància.
És especialment útil per a descriure els electrons deslocalitzats (enllaços $=$ en diferents posicions) en unes certes molècules o ions poliatòmics.

Propietats de les substàncies covalents moleculars

- A causa de les febles interaccions entre molècules covalents, solen tenir temperatures de fusió i ebullició baixes (molts compostos covalents són líquids o gasos a temperatura ambient).
- En estat sòlid són compostos tous i fràgils.
- Són mals conductors de la calor i de l’electricitat.
Propietats de les substàncies covalents cristal·lines
Les substàncies covalents cristal·lines contenen un gran nombre d’àtoms neutres units entre si mitjançant enllaços covalents, formant làmines bidimensionals, com el grafit o el grafè, o estructures tridimensionals, com el 💎 diamant o el quars.
Grafit/grafè

Diamant

- A causa dels forts enllaços covalents entre els àtoms, solen tenir temperatures de fusió i ebullició altes, per la qual cosa són sòlids a temperatura ambient.
- Són substàncies molt dures encara que fràgils.
- Solen ser mals conductors (no així el grafit o el grafè).
Geometria molecular
(continua cap avall)
👇
TRPECV
La Teoria de Repulsió de Parells d’Electrons de la Capa de València (TRPECV) es basa en el fet que, com els electrons de valència es repel·leixen els uns als altres, aquests tendeixen a adoptar una disposició espacial que minimitza aquesta repulsió.

Exemples
Lineal

Trigonal plana

Angular

Tetraèdrica

Piramidal trigonal

Bipiramidal trigonal

Balancí

Forma de T

Octaèdrica

Piramidal quadrada

Quadrada plana

TEV
La Teoria de l’Enllaç de València (TEV) es basa en el fet que els e– compartits es troben en una zona de solapament orbital:

Promoció electrònica
Consisteix a aportar energia extra als electrons aparellats de la capa de valència perquè ocupin un orbital de major energia (s’excitin) i permetin a l’àtom tenir més electrons solitaris amb els quals formar els enllaços que necessiti.
Hibridació
La hibridació consisteix a combinar orbitals atòmics de l’àtom central per a formar orbitals híbrids energèticament iguals i orientats en la direcció de l’enllaç.

Exemples
sp: BeCl2
El beril·li no té electrons desaparellats pel que es produeix promoció electrònica i hibridació perquè pugui formar dos enllaços Be—Cl.
Cadascun d’aquests híbrids sp se solapa frontalment amb un orbital p del clor, formant dos enllaços sigma:


sp2: BF3
El bor només té un electró desaparellat però necessita tres, per la qual cosa es produeix promoció electrònica i hibridació perquè pugui formar tres enllaços B—F.
Cadascun d’aquests híbrids sp2 se solapa frontalment amb un orbital p del fluor, formant tres enllaços sigma:


sp3: CH4
El carboni només té dos electrons desaparellats però necessita quatre, per la qual cosa es produeix promoció electrònica i hibridació perquè pugui formar quatre enllaços C—H.
Cadascun d’aquests híbrids sp3 se solapa frontalment amb un orbital s de l’hidrogen, formant quatre enllaços sigma:


Enllaços múltiples
Etè (CH2=CH2)
Cada carboni necessita formar un enllaç doble (amb l’altre C) i dos enllaços simples (amb H), per la qual cosa es necessita promoció electrònica i una hibridació sp2 per a tenir també un orbital pur p amb el qual formar un enllaç $\pi$ (solapament lateral).


Acetilè (CH≡CH)
Cada carboni necessita formar un enllaç triple (amb l’altre C) i un enllaç simple (amb H), per la qual cosa es necessita promoció electrònica i una hibridació sp per a tenir dos orbitals purs p amb els quals formar dos enllaços $\pi$ (solapament lateral).


Simulació
Explora les formes moleculars mitjançant la construcció de molècules en 3D amb la següent simulació:
Forces intermoleculars
Les forces intermoleculars són les forces que existeixen entre les molècules, incloent les forces d’atracció o repulsió que actuen entre les molècules i altres tipus de partícules veïnes, per exemple, àtoms o ions.
(continua cap avall)
👇
Les forces intermoleculars són febles en relació amb les forces intramoleculars (les que mantenen unida una molècula).
Forces de van der Waals

Es poden donar entre molècules polars (dipol-dipol, més fortes com més gran sigui la polaritat de la molècula), i apolars (anomenades forces de dispersió de London, més fortes com més grans i massives són les molècules involucrades).
Enllaços d’hidrogen
Són les forces intermoleculars més intenses. Es donen entre molècules que contenen àtoms d’hidrogen units a àtoms de nitrogen (N), oxigen (O) o fluor (F).

Els enllaços d’hidrogen són responsables de:
- Que l’aigua (H2O) tingui una temperatura d’ebullició anormalment alta (100 °C a pressió atmosfèrica).
- L’estructura de proteïnes i àcids nucleics, com la doble hèlix de l’ADN 🧬.
- L’estructura de polímers.

Exportar a PDF
📥 Fes clic aquí i segueix aquestes instruccions:
- Obre el diàleg d’Impressió (Control-P si ets al Windows).
- Canvia la Destinació a Desa com a PDF.
- Canvia el Disseny a Horizontal.
- Canvia els Marges a Cap.
- Activa l’opció Gràfics de fons.
El procés, en principi, només funciona amb Google Chrome.