Química orgànica
Descarrega aquestes diapositives en format PDF 📥
Repassa la formulació i la nomenclatura de Química Orgànica amb aquests apunts actualitzats a les últimes recomanacions de la IUPAC de 2013.
Isomeria
Dos compostos són isòmers entre si si tenen el mateix número i tipus d’àtoms, és a dir, si tenen la mateixa fórmula molecular. Dos compostos isòmers tenen el mateix nombre d’insaturacions.
(continua cap avall)
👇
Isomeria constitucional
Es deu a diferències en l’estructura dels compostos, és a dir, canvia com estan units els àtoms (tenen diferent connectivitat). Dins d’aquest tipus, hi ha tres subtipus d’isomeria:
(continua cap avall)
👇
Isomeria de cadena
Es presenta en compostos que difereixen en l’esquelet de la cadena carbonada:

Butà
Metilpropà (isobutà)
A la següent taula pots veure el nombre d’isòmers que presenten els hidrocarburs lineals saturats:
| núm. C | Nom | Isòmers | núm. C | Nom | Isòmers |
|---|---|---|---|---|---|
| 1 | Metà | 1 | 6 | Hexà | 5 |
| 2 | Età | 1 | 7 | Heptà | 9 |
| 3 | Propà | 1 | 8 | Octà | 18 |
| 4 | Butà | 2 | 9 | Nonà | 35 |
| 5 | Pentà | 3 | 10 | Decà | 75 |
Isomeria de posició
Es presenta en compostos que difereixen en la posició del seu grup funcional:

But–2–è
But–1–è
Butan–2–ol
Butan–1–ol
Isomeria de funció
Es presenta en compostos que tenen grups funcionals diferents. Solen ser isòmers de funció entre si:
- alcohols-èters,
- aldehids-cetones,
- i àcids carboxílics-èsters,
encara que existeixen moltes altres possibilitats.

Metil propil èter (metoxipropà)
Butan–1–ol
Propanal
Propanona (acetona)
Àcid propanoic
Etanoat/acetat de metil
Estereoisomeria
En aquest cas, l’estructura de les substàncies és la mateixa (igual connectivitat entre àtoms) però es diferencien en la seva orientació espacial.
(continua cap avall)
👇
Isomería geométrica (cis-trans)
La isomeria cis-trans es presenta en alguns alquens, a causa de la incapacitat de rotació del doble enllaç.
Perquè un doble enllaç present isomeria cis-trans, no pot haver-hi sobre qualsevol dels dos carbonis del doble enllaç dos substituents iguals.
Dos compostos amb aquesta mena d’isomeria geomètrica són diastereoisòmers, sent les seves propietats físiques diferents.
Els isòmers cis tenen tots dos substituents del doble enllaç cap a un costat, els trans cap a costats oposats:

cis–1,2–dicloroetè
trans–1,2–dicloroetè
L'1,1–dicloroetè no pot presentar isomeria cis-trans:

Aquest tipus d’isomeria es dona també en compostos amb un pla de simetria, a causa de la impossibilitat de rotació:

Notació E-Z
Quan existeixen diversos substituents diferents, la nomenclatura cis-trans en alquens pot resultar ambigua. En aquests casos s’adopta la nomenclatura E-Z. En alemany:
- E de entgegen (separats).
- Z de zusammen (junts).
A cada carboni del doble enllaç, el substituent de major nombre atòmic té major jerarquia. En cas d’empat, se segueix el mateix criteri amb els àtoms units a ells, fins a desempatar.
L’isòmer Z serà el que tingui els dos substituents de major jerarquia del mateix costat del doble enllaç i l’isòmer E serà el que els tingui a diferent costat:

(Z)–1–bromo–1–cloro–2–metilbut–1–è
(E)–1–bromo–1–cloro–2–metilbut–1–è
Un exemple del diferents que poden arribar a ser dos isòmers cis-trans ho tenim amb els àcids fumàric i maleic:

Àcid fumàric
Àcid maleic
Sent el primer fonamental en diverses rutes del metabolisme cel·lular, destacant la seva participació en el cicle de Krebs; i el segon tòxic. Les seves propietats físiques són molt diferents.
Isomeria conformacional
La isomeria conformacional no és matèria de batxillerat ni de PBAU.
Els alquens amb dobles enllaços conjugats poden adoptar dues diferents conformacions. Per exemple, en el buta–1,3–diè els dobles enllaços poden estar cap al mateix costat de l’enllaç simple o en costats oposats.
Seria incorrecte referir-nos a les dues possibilitats com cis i trans ja que són conformacions (dinàmic!) i no configuracions (estàtic).
És a dir, la molècula pot girar entorn de l’enllaç senzill i interconvertir-se d’una conformació a una altra, cosa que no pot ocórrer amb els isòmers cis i trans a causa de la rigidesa del doble enllaç o del cicle.
Aquests confòrmers s’anomenen amb el prefix “s” (de “sigma”, o de “simple” si preferiu).

Com hauràs estudiat a Biologia, els anells de 6 membres poden adoptar dues diferents conformacions: forma de cadira i forma de pot.
La forma de cadira és més estable, però la diferència d’estabilitat entre les dues és molt petita, per la qual cosa es converteixen fàcilment l’una en l’altra. Aquestes estructures presenten isomeria conformacional.

Isomeria òptica
La isomeria òptica es presenta quan un compost no és superponible amb la seva imatge especular, i en aquest cas es diu que són enantiòmers. Perquè això ocorri, la molècula ha de posseir almenys un carboni quiral.
Un carboni quiral és un carboni que té 4 substituents diferents:

Compte perquè pot ocórrer que un compost tingui dos centres quirals i que no presenti isomeria òptica.
Aquest és el tipus d’esteroisomeria que presenten molècules essencials per a la vida, com els aminoàcids i els monosacàrids.
Els enantiòmers tenen propietats físiques idèntiques, diferenciant-se únicament en el seu comportament enfront de la llum polaritzada, perquè la desvien de manera diferent (mesurable amb un polarímetre).
Si el pla de la llum polaritzada es desvia a la dreta són substàncies dextrògires i si es desvia a l’esquerra, levògires:
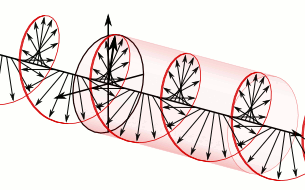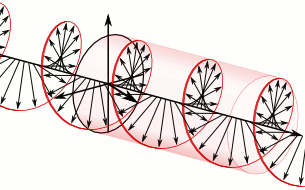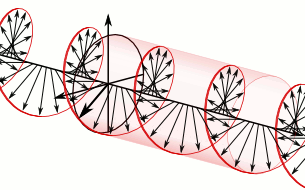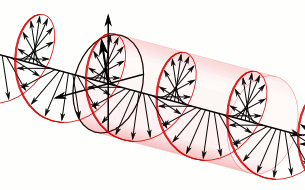
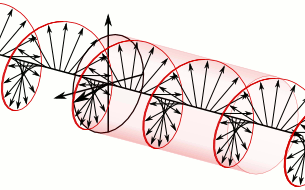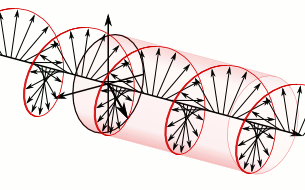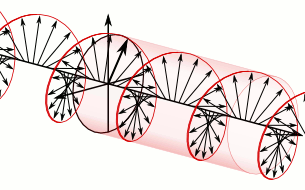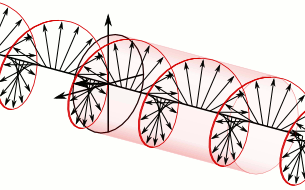

d-Alanina
l-Alanina
Projeccions de Fischer
Amb la finalitat de facilitar la representació en el pla, s’utilitzen les projeccions de Fischer, ideades pel químic alemany Hermann Emil Fischer al 1891, per a representar la disposició espacial de molècules en les quals un o més àtoms de carboni són quirals:

Reactivitat
- Reaccions de substitució
- Reaccions d’addició
- Reaccions d’eliminació
- Reaccions d’oxidació-reducció (redox)
- Reaccions de condensació i hidròlisi
(continua cap avall)
👇
Reaccions de substitució
A aquest tipus de reaccions un àtom o grup d’àtoms d’una molècula és substituït per un altre àtom o grup d’àtoms d’una altra molècula:

Halogenació d’alcans
Els alcans experimenten reaccions de substitució radicalaries. Així, es pot aconseguir la substitució d’un enllaç –C–H per un enllaç –C–X mitjançant radiació lluminosa.
S’anomena substitució fotoquímica i és una reacció en la qual la llum trenca la molècula d’halogen X2 (F2, Cl2, Br2 o I2) donant una reacció en cadena amb fórmula general:

La reacció pot continuar precisant a cada etapa llum o calor. En cada etapa es forma HX com a producte. La següent reacció està particularitzada per a (X = Cl). A cada etapa, a més del producte de substitució, es forma HCl:

Substitució d’un halogen per un altre

Transformació d’un derivat halogenat en un alcohol
La hidrólisis d’un haloalcà es duu a terme amb NaOH que dona la substitució de l’halogen pel grup –OH, donant l’alcohol:

Transformació d’un derivat halogenat en un èter

Transformació d’un derivat halogenat en una amina primària

Transformació d’un derivat halogenat en una amina secundària (o terciària)

Reaccions d’addició
Una molècula incorpora a la seva estructura una altra molècula. Ocorren amb substrats amb dobles o triples enllaços originant un producte amb un major grau de saturació.
Hidrogenació catalítica d’alquens
Es realitza amb hidrogen molecular en presència d’un catalitzador, normalment platí. És un procés exotèrmic.
La reacció transcorre de manera que cada àtom d’hidrogen de la molècula H2 s’afegeix a un dels dos carbonis que formen l’enllaç múltiple en el reactiu, saturant la molècula:

Hidrogenació d’un alquí

Halogenació d’alquens
De manera anàloga a la hidrogenació, l’halogen X2 afegeix un àtom d’halogen a cada carboni que forma l’enllaç múltiple formant un dihalogen veïnal:

Halogenació d’un alquè

Halogenació d’un alquí

Hidrohalogenació d’alquens
L’halur d’hidrogen HX s’afegeix a l’enllaç múltiple:

Hidrohalogenació d’un alquè

Hidrohalogenació d’un alquí

Hidratació d’alquens
La reacció succeeix en el tractament de l’alquè amb aigua i un catalitzador àcid fort, com el H2SO4, per un mecanisme similar al de l’addició de HX. L’aigua H2O també s’afegeix a l’enllaç múltiple:

Hidratació d’un alquè

Reaccions d’eliminació
Una molècula perd àtoms en posicions adjacents i origina una molècula amb un enllaç doble o triple. Les reaccions d’eliminació són les reaccions inverses a les d’addició a un doble enllaç.
A les reaccions d’eliminació es perden àtoms de dos carbonis veïnals produint-se majoritàriament el doble enllaç més substituït.
Deshidrogenació
És la reacció inversa a la hidrogenació, i es dona amb un catalitzador i calor, donant l’alquè:

Deshidrohalogenació d’halurs d’alquil
És la reacció inversa a la hidrohalogenació, es produeix en presència de KOH i alcohol en la qual s’elimina KX i H2O, originant un doble enllaç.
La deshidrohalogenació produeix majoritàriament el producte amb el doble enllaç més substituït:

Deshidrohalogenació de dihalurs veïnals
Com al cas anterior, s’eliminen molècules de HX, en aquest cas 2 molècules HX, originant un enllaç triple. Aquesta reacció es produeix en presència d’un catalitzador:

Deshidratació d’alcohols
És la reacció inversa a la hidratació d’alcohols. Es produeix en medi àcid, generalment H2SO4, i calor.
La deshidratació (pèrdua d’una molècula d’aigua) produeix, majoritàriament, el doble enllaç més substituït:

Reaccions de oxidació-reducció (redox)
A les reaccions d’oxidació, el carboni que té unit un hidroxil (–OH) s’oxida. Aquesta oxidació té lloc per pèrdua d’un hidrogen unit al C i de l’hidrogen del grup –OH, formant-se un doble enllaç C=O conegut com a grup carbonil.
Com a substància oxidant [Ox] pot usar-se dicromat de potassi K2Cr2O7 o permanganat de potassi KMnO4 en medi àcid.
La reacció inversa a l’oxidació és la reducció. Com a substància reductora [Red] sol usar-se tetrahidrur d’alumini-liti, LiAlH4.
Alcohols primaris
Com en els alcohols primaris el grup –OH està unit a un carboni terminal, en oxidar-se produeix un carbonil terminal donant lloc a un aldehid, –CHO. Si l’oxidació continua l’aldehid s’oxida a àcid carboxílic:

Alcohols secundaris
En el cas dels alcohols secundaris, l’oxidació del carboni produeix un carbonil no terminal, conegut com a grup cetona. La cetona no pot continuar oxidant-se:

Alcohols terciaris
L’oxidació es produiria per pèrdua d’un hidrogen unit al carboni que s’oxidaria, per la qual cosa aquest ha de tenir disponible almenys un. Per aquest motiu, els alcohols terciaris no donen reaccions d’oxidació:

Reaccions de combustió
La reacció de combustió d’un compost orgànic en atmosfera rica en oxigen dona lloc als òxids dels seus elements.
Si el compost és un hidrocarbur, oxigenat o no, els productes de la reacció són diòxid de carboni i aigua, que són els òxids del carboni i de l’hidrogen:
Les reaccions de combustió són reaccions exotèrmiques. Si el compost té altres elements, com a N o S, també habituals en química orgànica, s’obtenen els òxids d’aquests.
Reaccions de condensació i hidròlisi
- Reacció d’esterificació i saponificació
- Reacció de condensació d’alcohols
- Reacció de condensació per donar amides
(continua cap avall)
👇
Reacció d’esterificació i saponificació
L’esterificació és la reacció de condensació entre un àcid carboxílic i un alcohol, per pèrdua d’aigua, produint-se un èster:

La saponificació és la reacció inversa a l’esterificació. La hidròlisi de l’èster dona l’àcid carboxílic i l’alcohol. S’entén per saponificació la reacció que produeix la formació de sabons. La principal causa és la dissociació dels greixos en un medi alcalí, separant-se glicerina i àcids grassos. Aquests últims s’associen immediatament amb els àlcalis constituint les sals sòdiques dels àcids grassos: el sabó.
Reacció de condensació d’alcohols
La formació de l’èter competeix amb l’eliminació d’aigua per a donar l’alquè. Les condicions de reacció determinaran quina és la reacció majoritària:

Reacció de condensació per a donar amides
L’amoníac, les amines primàries i les amines secundàries reaccionen amb els àcids carboxílics per a donar amides. És una reacció de condensació en la qual s’allibera aigua.
La seva inversa, la reacció d’hidròlisi, permet obtenir l’amina i l’àcid corresponent:

Polímers
Els polímers (també anomenats macromolècules) són molècules molt grans formades a partir de la repetició d’unitats més petites anomenades monòmers.
A aquesta entrada del blog (en espanyol) analitzem les principals propietats i usos dels sis plàstics bàsics o de consum (commodity plastics en anglès).
Aprèn a anomenar polímers amb aquesta guia breu de la IUPAC.
Classificació dels polímers
Existeixen polímers naturals com els polisacàrids, les proteïnes o el cautxú (natural) i altres sintètics: polietilè (PE), niló, polièster, PVC, PET…
Respecte al comportament a temperatures elevades, els polímers es classifiquen com a termoplàstics o termoestables.
Els termoplàstics (PET, PE, PVC, PP, PG…) s’estoven quan s’escalfen i s’endureixen quan es refreden.
Els termoestables (Poliuretà (PUR)) una vegada s’han endurit no s’estoven per escalfament.
Respecte als tipus d’unitats repetitives, si totes són del mateix tipus és un homopolímer i si conté dos o més tipus d’unitats repetitives és un copolímer.
Síntesi de polímers
Els polímers es poden sintetitzar per dues rutes: reacció en cadena (polimerització per addició) o reacció per etapes (polimerització per condensació).
Polímers per creixement en cadena o polímers d’addició
S’obtenen a partir de la formació de llargues cadenes de monòmers que s’uneixen unes a altres sense que existeixi pèrdua de cap molècula en el procés:
Iniciació

Creixement

Terminació

Polímers per creixement per etapes o polímers de condensació
S’obtenen per reacció entre dos monòmers, cadascun dels quals té, almenys, dos grups funcionals, amb eliminació d’alguna molècula (per exemple aigua).
Els polièsters són polímers de condensació que s’obtenen a partir de diols i àcids dicarboxílics, que donen lloc als grups èster característics del polímer:

Exportar a PDF
📥 Punxa aquí i segueix aquestes instruccions:
- Obre el diàleg d’Impressió (Control-P si estàs en Windows).
- Canvia el Destí a Guardar com PDF.
- Canvia el Disseny a Horitzontal.
- Canvia els Marges a Cap.
- Activa l’opció Gràfics de fons.
El procés, en principi, només funciona amb Google Chrome.